細(xì)胞培養在(zài)實驗(yàn)完(wán)成後需(xū)要(yào)将細胞凍存存放起來,以便(biàn)以後實驗需要(yào),可以(yǐ)将凍存的(de)細胞直接複蘇(sū)使用(yòng)。然(rán)而(ér)爲了(le)使複蘇(sū)得到的細胞(bāo)狀态(tài)好,可(kě)直接用于實驗(yàn),細胞(bāo)在(zài)凍存時(shí)的狀态就顯得(dé)尤爲(wèi)重(zhòng)要,一(yī)定(dìng)要選擇細胞培(péi)養狀(zhuàng)态好的時(shí)候将細胞凍存起來,其次(cì)是凍(dòng)存細胞的方式(shì)和條件,凍(dòng)存液(yè)的選擇等(děng)對細(xì)胞凍(dòng)存(cún)都很重要。

細胞培養在實驗完(wán)成後需(xū)要将細胞凍存(cún)存放(fàng)起(qǐ)來,以便以後(hòu)實(shí)驗需要(yào),可以将凍存的(de)細胞直接(jiē)複蘇(sū)使用。然而爲了(le)使複蘇得(dé)到的(de)細胞狀(zhuàng)态好,可直接用于(yú)實驗(yàn),細胞在凍存時(shí)的狀态就顯得尤爲重要,一定(dìng)要選擇細胞培養狀态好的時(shí)候将細胞凍存起來,其次是凍(dòng)存細(xì)胞(bāo)的方式(shì)和條(tiáo)件(jiàn),凍存液(yè)的選擇等對細(xì)胞凍存(cún)都很重(zhòng)要。
下面簡單介(jiè)紹一下細胞凍存方(fāng)面的知識(shí)
一、什(shí)麽(me)是(shì)細胞(bāo)凍存?
細胞(bāo)放在(zài)低溫(wēn)環境,減少(shǎo)細胞代謝(xiè),以便長期儲存。
二、細(xì)胞凍存(cún)的具體(tǐ)操作步(bù)驟
1、配制(zhì)含10%dmso、90%胎牛血(xuè)清的凍存液(yè)或市面(miàn)上購買的(de)凍存(cún)液(yè)。
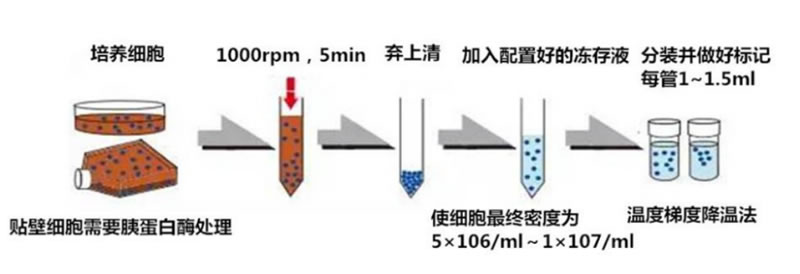
2、從培養箱取(qǔ)出細胞培養瓶(píng)(一般選擇(zé)處于(yú)對數期(qī)的(de)細胞(bāo)),轉移(yí)到超(chāo)淨台(tái)。棄去原有培養(yǎng)液,用1-2ml pbs緩沖液洗(xǐ)滌1次(注(zhù)意(yì)從側壁加入(rù),以免沖(chòng)掉細胞),棄去pbs緩沖液(yè)。
3、向培(péi)養瓶(píng)中加(jiā)入1ml胰酶,消化,将加入(rù)胰酶的細(xì)胞(bāo)培(péi)養瓶(píng)轉移(yí)到倒置顯(xiǎn)微鏡下觀察細(xì)胞消(xiāo)化情況,當(dāng)細胞(bāo)變圓(yuán)且大(dà)量脫(tuō)落(luò)時,轉移到超淨台。
4、加入(rù)2ml完全培養(yǎng)基,終(zhōng)止消化。用(yòng)移液器充(chōng)分緩慢吹打,使細胞能夠完全脫落。然後(hòu)将細胞(bāo)懸液轉(zhuǎn)移至15ml離心(xīn)管中(zhōng),1000rpm/min離心(xīn)5分鍾(zhōng),轉移(yí)進超淨(jìng)台,打開(kāi)蓋子,棄(qì)去(qù)上清。
5、加(jiā)入适量凍存(cún)液,用移液器輕(qīng)輕吹(chuī)打(dǎ)細胞團(tuán)塊,制備(bèi)成(chéng)細胞懸液(yè),調節(jiē)凍存(cún)液(yè)中細(xì)胞密度(dù),根據經驗按照(zhào)t25培養瓶一(yī)瓶凍存2-3管,将細胞分(fèn)裝入凍(dòng)存管中(zhōng),每(měi)管(guǎn)1-1.5 ml。
6、在凍存管(guǎn)上标(biāo)明細胞的名稱,凍存(cún)時間(jiān)及操作者。
7、将裝有細胞的凍存(cún)管放入4℃冰箱30min,後(hòu)-20℃冰箱30min,然後放入(rù)-80℃冰箱中過夜,取(qǔ)出凍存管(guǎn),移入(rù)液氮容器(qì)内。或(huò)按照凍存液說(shuō)明書操作。

注意事項(xiàng)
1.使用(yòng)dmso前,不需要進行(háng)高壓(yā)滅菌(jun1),它本身就(jiù)有滅菌(jun1)的作用(yòng)。高壓(yā)滅(miè)菌反而會破壞它的分(fèn)子結(jié)構,以至于(yú)降低冷凍(dòng)保護效果(guǒ)。在常溫下(xià),dmso對人體有害(hài),故在配制時(shí)最好戴上(shàng)手(shǒu)套(tào)操作(zuò)。
2.細胞凍存注意(yì)要慢(màn)凍,按照溫度梯度降溫法(fǎ)進行,不宜将凍存細胞(bāo)放置在(zài)0℃~-60℃這一溫度(dù)範圍(wéi)内過久(jiǔ),低溫損(sǔn)傷主(zhǔ)要(yào)發(fā)生在(zài)這一溫(wēn)度區内,是“危險溫區”,實驗操作中(zhōng)可将(jiāng)細胞凍存(cún)管裝(zhuāng)在程序降溫(wēn)盒(hé)中再放(fàng)入-80℃冰箱,使之以(yǐ)約(yuē)1℃/min的降(jiàng)溫速度渡過“危(wēi)險溫(wēn)區(qū)”後保留(liú)在低溫(wēn)冰箱或(huò)轉移(yí)至液氮罐(guàn)。
3.注意定期(qī)檢查液氮(dàn)罐内液氮(dàn)量,及時添(tiān)加。

